Hyperthermie: de kracht van warmte
Waar wilt u meer informatie over?
Centrum Hyperthermie Amsterdam
Het Centrum Hyperthermie Amsterdam is in 2007 opgericht.
Met persoonlijke aandacht passen wij hyperthermie toe.
‘Hyperthermie’ betekent letterlijk ‘verhoogde temperatuur’.
De kankercellen worden dus bestreden met warmte.
Dit gebeurt vrijwel altijd in combinatie met een andere behandeling,
zoals chemo-, immuun-, hormoon- en/of radiotherapie.
Hyperthermie kan helpen bij verschillende soorten kanker.
Blog
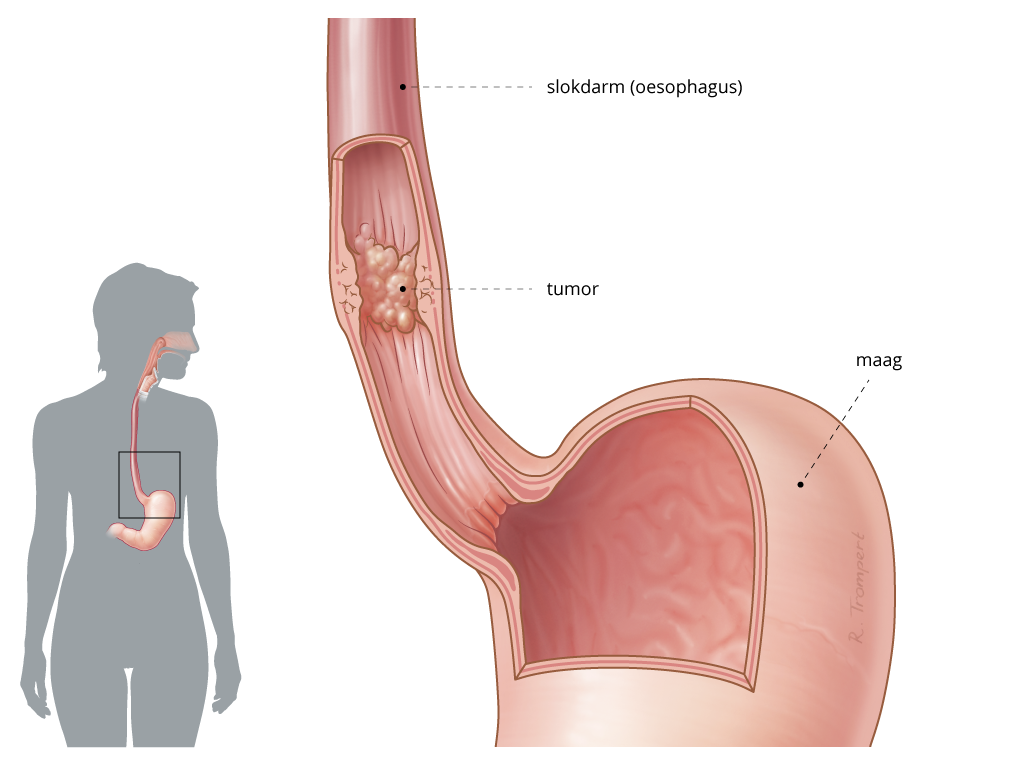
Hyperthermie bij Slokdarmkanker
Jaarlijks wordt bij ongeveer 4000 Nederlanders de diagnose slokdarm-of maagkanker gesteld.
Bij bijna 3000 patiënten gaat het over slokdarmkanker of kanker in het overgangsgebied tussen slokdarm en maag.
Bezoek aan INMOA van M. Bachrach
Bezoek van M. Bachrach (praktijkhouder/manager Centrum Hyperthermie) aan INMOA Madrid op 29.12.2023. Tijdens dit bezoek een ontmoeting en gesprek met mw. dr. E. Arrojo (praktijkhouder en radiotherapeut-oncoloog).
Kans op kanker toegenomen naar 1 op de 2 Nederlanders
Ongeveer 1 op de 2 Nederlanders krijgt in hun leven te maken met kanker, volgens recente cijfers. Lees er hier meer over.
Hyperthermie: ook bij ziekte van Lyme en sportblessures
Hyperthermie is een goede aanvullende therapie bij kanker, maar wist je dat het ook bij andere aandoeningen kan worden toegepast? Je leest het hier.
Behandeling uitgelicht: immunotherapie
Wanneer je graag in behandeling wilt in combinatie met hyperthermie, kan het zijn dat je je gehinderd voelt of bang bent dat je niet te behandelen bent. Lees hier of hyperthermie voor jou geschikt is.
Hyperthermie: ook bij triple negatief borstkanker mogelijk?
Hyperthermie is een goede aanvullende therapie bij kanker. Ook bij triple negatief borstkanker kan hyperthermie een posotieve bijdrage leveren. Je leest het hier.
6 vragen over een aanvullende behandeling met hyperthermie
Wanneer je graag in behandeling wilt in combinatie met hyperthermie, kan het zijn dat je je gehinderd voelt of bang bent dat je niet te behandelen bent. Lees hier of hyperthermie voor jou geschikt is.
Het verhaal van… Peter, patiënt met endeldarmkanker
Wanneer je graag in behandeling wilt in combinatie met hyperthermie, kan het zijn dat je je gehinderd voelt of bang bent dat je niet te behandelen bent. Lees hier of hyperthermie voor jou geschikt is.
5 tips om met je kankerdiagnose om te gaan
Na je kankerdiagnose komt er ineens enorm veel op je af. Hoe ga je daarmee om? Speciaal voor jou 5 tips. Lees ze hier.
Ervaringen
In de behandeling van uitgezaaide darmkanker (diverse operaties, Hipec spoeling, Chemotherapie), ervaar ik de wekelijkse Hypertherherapie met aanvullend intraveneus Vitamine C, als een niet belastende, energie opwekkende behandeling. Na een “mislukte” Chemo behandeling hebben we gekozen voor een non-toxic traject…
Het is zondermeer aan te bevelen om uw kankerbehandeling te verbreden en dan is hyperthermie bij dit centrum zeer waardevol.
Ik was daarom super blij dat Hyperthermie Centrum Amsterdam bleek te bestaan, en vooral ook dat ik ontzettend warm en met persoonlijke aandacht ontvangen werd. Het hele team is zo prettig, en heeft binnen de richtlijnen respect voor individuele behandelkeuzes.

Heeft u vragen?
In een lastige periode in uw leven kunnen vragen als moeilijk ervaren worden. We hebben hiervoor veel gestelde vragen op een rijtje gezet.