Hyperthermie versterkt radiotherapie en/of chemotherapie
Samenvatting
Hyperthermie, het opwarmen van tumoren tot 40- 43°C, wordt gegeven voor verschillende tumorindicaties ter versterking van het effect van radiotherapie en chemotherapie. Dit artikel geeft een overzicht van de biologische rationale, de behandelmethoden, de huidige klinische toepassingen en de klinische bewijzen van de waarde van milde hyperthermie. Hyperthermie werkt onder andere door frustratie van DNA-schadeherstel en verminderen van hypoxie.

Er zijn verschillende hyperthermietechnieken beschikbaar, afhankelijk van tumorstadium en locatie. Er bestaat een grote hoeveelheid klinisch bewijs voor het versterkende effect van hyperthermie. In een aantal systematische overzichtsartikelen werd een klinisch relevant voordeel beschreven van het toevoegen van hyperthermie aan radiotherapie in 42 vergelijkende studies, waarvan 22 gerandomiseerd: onder andere voor cervix-uteri-carcinoom (6 studies, CR 79,6% versus 65,7%), recidief mammacarcinoom (6 studies, CR 61,6% versus 48,6%) en hoofd-halstumoren (9 studies, CR 75,3% versus 50,3%). Ook wordt in vier gerandomiseerde studies een klinisch relevant voordeel gezien van het toevoegen van hyperthermie aan chemotherapie. Dit is het meest relevant voor HIPEC bij ovariumcarcinoom, voor sarcomen en voor intravesicale applicatie bij niet-spierinvasieve blaastumoren. Er is zowel biologische rationale als bewijs uit (gerandomiseerde) studies voor de klinische effectiviteit van hyperthermie in combinatie met radiotherapie en/of chemotherapie.
Inleiding
Hyperthermie, het opwarmen van tumoren tot 40-43°C, wordt gegeven voor verschillende tumorindicaties ter versterking van het effect van radiotherapie en chemotherapie. Naast deze (milde) hyperthermie bestaan thermische therapieën die door het verwarmen tot temperaturen hoger dan 50 graden (bijvoorbeeld ‘radio frequency ablation’ (RFA) en ‘high intensity focussed ultrasound’ (HIFU)) of lager dan 0°C (cryotherapie) lokale tumornecrose proberen te bewerkstelligen. Deze methoden vallen buiten het onderwerp van dit artikel. Ondanks de biologische rationale en de beschikbare bewijzen voor effectiviteit van milde hyperthermie is de methode niet erg wijd verbreid. In vele landen wordt hyperthermie niet vergoed, waardoor het ook niet in richtlijnen wordt opgenomen. Verder is de behandeling betrekkelijk arbeidsintensief, hetgeen instituten terughoudend maakt hierin te investeren. Het bewijs voor hyperthermie is solide, mits toegepast in combinatie met radiotherapie en/of chemotherapie. In Nederland wordt hyperthermie breed toegepast in het kader van hypertherme intraperitoneale chemotherapie (HIPEC) bij peritoneale uitzaaiingen van coloncarcinoom en ovariumcarcinoom. Ook wordt hyperthermie gecombineerd met chemotherapie bij oppervlakkig blaascarcinoom in het Radboudumc en een toenemend aantal andere instituten.

Biologische rationale
Verschillende biologische mechanismen zijn verantwoordelijk voor het therapeutische effect van milde hyperthermie waarvan we hier alleen de meest relevante zullen noemen.1,2 Milde hyperthermie wordt uitsluitend in combinaties met chemotherapie of radiotherapie gebruikt met als doel de effectiviteit van deze modaliteiten te versterken. Hyperthermie heeft in het genoemde temperatuurbereik een direct therapeutisch effect, met name op tumorcellen die acidotisch en hypoxisch zijn en dus minder gevoelig voor radiotherapie. Hyperthermie induceert apoptose en activeert ‘heat shock’-proteïnen, remt angiogenese en heeft een (gering) direct cytotoxisch effect.3-7 Ook treedt bij lokale toepassing van hyperthermie bij temperaturen vanaf 39°C vaatverwijding op in het verwarmde gebied, met als gevolg een verbeterde perfusie en afname van eventueel aanwezige hypoxie. De verhoogde perfusie leidt tot een verbeterde afgifte en verdeling van chemotherapie, verminderde hypoxie leidt tot verhoogde effectiviteit van radiotherapie.8 Dit is vooral relevant bij tumoren die door die hypoxie juist minder gevoelig zijn voor radiotherapie. Directe synergie wordt bereikt bij temperaturen boven 41°C, hyperthermie maakt bij deze temperaturen de tumor tijdelijk BRCA2-deficiënt en blokkeert daarmee een belangrijk deel van het DNA-schadeherstel.9 Hiermee wordt het therapeutisch effect van radiotherapie en veel vormen van chemotherapie aanzienlijk versterkt. Daarom wordt onderzocht of zogenoemde ‘synthetic lethality’ door complete blokkade van DNA-schadeherstel in tumoren kan worden bereikt door combinatiebehandelingen met onder andere hyperthermie.10 Optimale therapeutische werking vereist dat hyperthermie bij voorkeur tegelijk met de chemotherapie wordt gegeven, en relatief kort voor of na de radiotherapie en met een zo hoog mogelijke temperatuur.11 Een belangrijk gegeven is verder dat de versterking van het effect van de radiotherapie en/of chemotherapie doorgaans tumorselectief is, mits chemotherapie alleen op de locatie van de tumor met hyperthermie wordt gecombineerd en mits radiotherapie kort voor of na de hyperthermie wordt gegeven.11 Hyperthermie heeft ook zogenoemde ‘ab-scopal’ effecten, dat zijn immunogene effecten waardoor naast verbeterde lokale tumorcontrole in het gebied dat met radiotherapie en hyperthermie wordt behandeld ook buiten dat gebied systemische effecten optreden die kunnen leiden tot langere overleving.12,13
Behandelmethoden
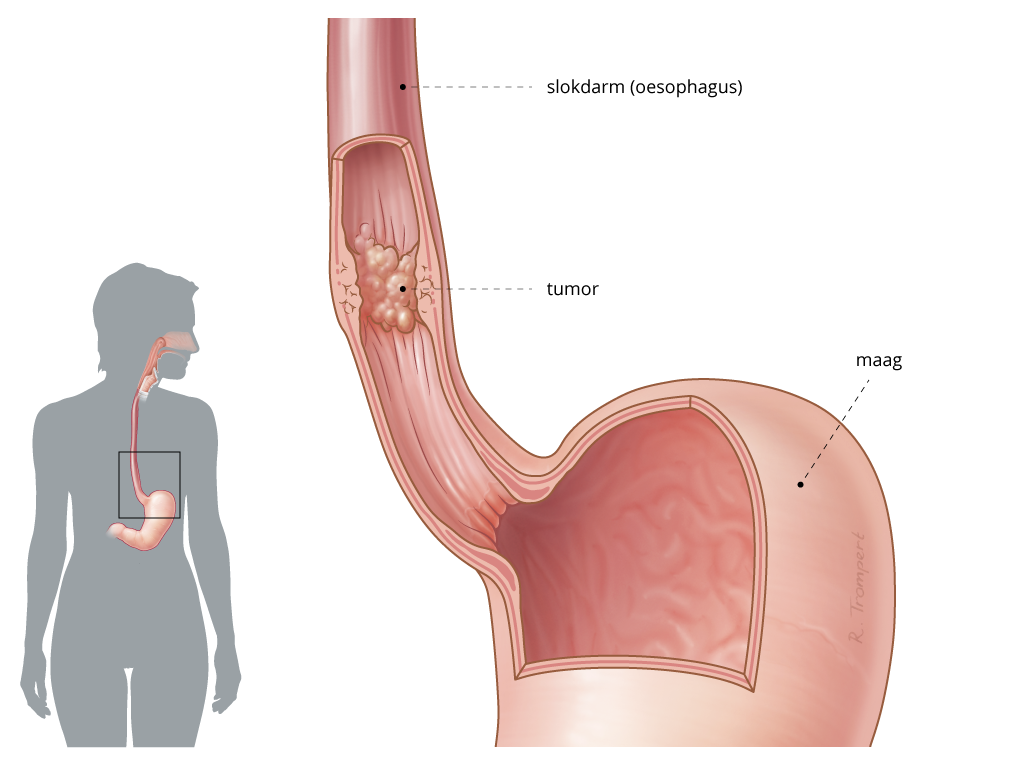
De hyperthermiebehandeling begint met opwarming totdat in het doelgebied de streeftemperatuur is bereikt en duurt daarna doorgaans een uur op deze streeftemperatuur. Er zijn verschillende hyperthermietechnieken beschikbaar, afhankelijk van tumorstadium en locatie. Bij recidiverend mammacarcinoom en andere tumoren in de huid of dicht daaronder wordt meestal gebruikgemaakt van antennes die microgolven van 434 MHz of 915 MHz uitzenden met een indringdiepte en verwarming van enkele centimeters.14 Het bereiken en handhaven van de streeftemperatuur in het doelgebied wordt tijdens de behandeling gecontroleerd met temperatuursensoren op de huid en onderhuids door middel van onder lokale anesthesie ingebrachte cathetertjes. Voor het verwarmen van dieper gelegen tumoren wordt meestal gebruikgemaakt van een ring van vier of meer antennes rond de patiënt, onder andere bij blaas-, rectum-, prostaat- en cervix-uteri-carcinoom. De hierbij gebruikte antennes zenden op een lagere frequentie van 70-150 MHz uit om een betere indringdiepte te bereiken, daarbij wordt niet alleen de tumor, maar ook de regio rond de tumor opgewarmd.15 Voorafgaand aan de behandeling wordt een planning uitgevoerd om de antenne-instellingen te berekenen die een optimale tumoropwarming geven, waarbij te hoge temperaturen in het gezonde weefsel worden vermeden.16 Bij sommige locaties, zoals de urineblaas, kan ook een hyperthermieapplicator in het orgaan zelf worden ingebracht.17,18 Voor peritoneaal gemetastaseerde ziekte, met name bij colonof ovariumcarcinoom, wordt veelvuldig hypertherme intraperitoneale chemotherapie (HIPEC) gebruikt, waarbij na chirurgische tumordebulking de buikholte wordt nagespoeld met een chemotherapieoplossing op 41-43°C om micrometastasen te elimineren.19
Klinische resultaten hyperthermie toegevoegd aan radiotherapie
Er bestaat een grote hoeveelheid klinisch bewijs voor het synergetische en versterkende effect van hyperthermie op de behandeling door middel van radiotherapie en chemotherapie. Datta et al. publiceerden een meta-analyse van 37 vergelijkende studies (20 gerandomiseerd en 17 niet-gerandomiseerd) bij hoofd-halscarcinoom, cervixcarcinoom, mammacarcinoom, rectumcarcinoom, blaascarcinoom oesofaguscarcinoom, longcarcinoom, oppervlakkige tumoren en diverse andere tumortypen, waarin totaal 1.717 patiënten die waren bestraald werden vergeleken met 1.761 patiënten die een combinatie van radiotherapie met hyperthermie hadden gehad (zie Tabel 1). De ‘overall complete response rate’ in deze 37 vergelijkende studies was 39,8% na radiotherapie alleen versus 54,9% na radiotherapie met hyperthermie, oddsratio 2,30 (95% betrouwbaarheidsinterval (BI) 1,95-2,72; p p<0,001).20 Daarnaast werd in dit overzicht een vijftal gerandomiseerde studies genoemd waarin ‘complete response rate’ niet als eindpunt was meegenomen. Eén daarvan vond geen voordeel van hyperthermie bij cervix-uteri-carcinoom, maar de andere vonden een voordeel in tijd tot progressie bij glioblastoma multiforme, een overlevingsvoordeel en ziektevrij overlevingsvoordeel voor nasofarynxcarcinoom en een overlevingsvoordeel bij preoperatieve radiochemotherapie voor maagcarcinoom.21-24 Eén gerandomiseerde studie toonde aan dat het toevoegen van hyperthermie aan protontherapie bij de behandeling van melanoom van de uvea de kans op secundaire enucleatie reduceerde.25 Datta et al. schreven verder overzichtsartikelen over toepassing van hyperthermie bij specifieke indicaties als hoofd-halstumoren, cervix-uteri-carcinoom en mammacarcinoom. Uit de laatste studie bleek dat hyperthermie vooral toegevoegde waarde heeft bij lokaal recidief mammacarcinoom in eerder bestraald gebied. Bij cervix-uteri-carcinoom verbetert hyperthermie niet alleen het responspercentage en de lokale controle, maar is er ook een trend voor een verbeterde overleving.26-28 Opvallend bij al deze overzichtsartikelen is dat ondanks een verbetering van tumorgerelateerde eindpunten in het gros van de gerapporteerde studies geen toename van vroege of late morbiditeit van graad 3 en hoger als gevolg van de toevoeging van hyperthermie wordt gezien.
Hyperthermie toegevoegd aan chemotherapie
In een deel van de bovengenoemde studies over versterking van het effect van radiotherapie betreft het behandelingen waarbij de radiotherapie was gecombineerd met chemotherapie, zodat mogelijk ook een versterking van het chemotherapie-effect een rol kan hebben gespeeld.20,23,25,27 Er zijn ook gerandomiseerde studies waarbij men specifiek heeft gekeken naar de versterking van het chemotherapie-effect door lokale of regionale hyperthermie. Intravesicale mitomycine C met of zonder verwarming voor oppervlakkig blaascarcinoom werd gerandomiseerd onderzocht bij 83 patiënten en toonde een verbetering van 15% naar 53% ziektevrije tienjaarsoverleving (p<0,001).29 Een gerandomiseerde studie van preoperatieve bleomycine en cisplatine met of zonder hyperthermie bij 40 patiënten met slokdarmcarcinoom toonde een verbetering van het pathologisch responspercentage van 18,8 naar 41,2%.30 Een gerandomiseerde studie bij 80 patiënten met stadium 3 en 4 niet-kleincellig longcarcinoom toonde geen verbetering aan door toevoeging van hyperthermie aan gemcitabine en cisplatine.31 De ‘European Organisation on Research in Treatment of Cancer’ (EORTC) verrichtte in samenwerking met de ‘European Society for Hyperthermic Oncology’ (ESHO) een gerandomiseerde studie waarbij 341 patiënten met een maligne hoog risico sarcoom preoperatief met etoposide, ifosfamide en doxorubicine met (n=169) of zonder (n=172) hyperthermie werden behandeld.32 Deze studie toonde bij een mediane follow-up van 11 jaar een significant voordeel in locoregionale controle (hazardratio 0,65; 95%-BI 0,49-0,86; p=0,002), ziektevrije overleving (hazardratio 0,71; 95%-BI; 0,55-0,93; p=0,01) en algehele overleving (hazardratio 0,73; 95%-BI 0,54-0,98; p=0,04).33 In een recente Nederlandse gerandomiseerde studie werd aangetoond dat hyperthermische intraperitoneale chemotherapie, toegevoegd aan intervaldebulkingoperatie bij stadium III-ovariumcarcinoom leidde tot een verbetering in de ziektevrije overleving (hazardratio 0,66; 95%-BI 0,50-0,87; p=0,003) en algehele overleving (hazardratio 0,67; 95%-BI 0,48-0,94; p=0,02).34 Bij deze studies werd geen significante toename van morbiditeit graad 3 en hoger door de toevoeging van hyperthermie aan chemotherapie gevonden. Sommige schema’s die in bovengenoemde studies werden gehanteerd zijn inmiddels niet meer in zwang; de winst door toevoeging van hyperthermie aan actuelere schema’s zou in die gevallen opnieuw moeten worden aangetoond. Naast deze bewijzen uit vergelijkende studies zijn vele observationele studies gepubliceerd en ook een aantal overzichtsartikelen met een wat lager niveau van bewijskracht, gezien het ontbreken van gerandomiseerde of anderszins vergelijkende studies. Enkele daarvan willen we hier noemen. Een zeldzame, maar toenemend belangrijke aandoening is het stralengeassocieerde sarcoom in de borst of op de borstwand na eerdere behandeling van borstkanker. In onze ervaring bleken deze tumoren goed te reageren op herbestraling en hyperthermie.35 Een overzicht van de literatuur suggereerde dat bij deze tumoren herbestraling met of zonder hyperthermie, toegevoegd aan chirurgie, een beter resultaat zou opleveren dan chirurgie alleen.36 De tumoreigenschappen van het pancreascarcinoom (agressief, weinig gevoelig voor radiotherapie en chemotherapie, veel stroma, vaak hypoxische tumoren) suggereren dat ook bij deze carcinomen hyperthermie tot een versterking van het effect van chemotherapie of radiotherapie zou kunnen leiden. Een overzicht van observationele studies bij pancreascarcinoom suggereert dat toevoeging van hyperthermie aan chemotherapie de respons en algehele overleving zou kunnen verbeteren.37 Momenteel zijn in Europa twee gerandomiseerde studies gaande die de toevoeging van hyperthermie aan chemotherapie prospectief onderzoeken; één in de adjuvante setting en één voor lokaal uitgebreide ziekte.38,39
Conclusie
Ondanks heterogene gegevens met niet altijd eenduidig gekozen eindpunten is er zowel biologische rationale als bewijs uit (gerandomiseerde) studies voor de klinische effectiviteit van hyperthermie toegepast in combinatie met radiotherapie en/of chemotherapie, waarbij hyperthermie het therapeutisch effect versterkt zonder versterking van de bijwerkingen. De toegevoegde waarde van hyperthermie aan radiotherapie is het meest evident voor cervix-uteri-carcinoom, recidief mammacarcinoom en hoofd-halstumoren. De toegevoegde waarde van hyperthermie aan chemotherapie is het meest evident voor HIPEC bij ovariumcarcinoom, sarcomen en intravesicale applicatie bij niet-spierinvasieve blaastumoren.
Referenties
1. Horsman MR, Overgaard J. Hyperthermia: a potent enhancer of radiotherapy. Clin Oncol 2007;19:418-26.
2. Issels R, Kampmann E, Kanaar R, et al. Hallmarks of hyperthermia in driving the future of clinical hyperthermia as targeted therapy: translation into clinical application. Int J Hyperthermia 2016;32:89-95.
3. Ohno S, Siddik ZH, Kido Y, et al. Thermal enhancement of drug uptake and DNA adducts as a possible mechanism for the effect of sequencing hyperthermia on cisplatin-induced cytotoxicity in L1210 cells. Cancer Chemother Pharmacol 1994;34:302-6.
4. Panteix G, Beaujard A, Garbit F, et al. Population pharmacokinetics of cisplatin in patients with advanced ovarian cancer during intraperitoneal hyperthermia chemotherapy. Anticancer Res 2002;22:1329-36.
5. Spratt JS, Adcock RA, Muskovin M, et al. Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res 1980;40:256-60.
6. Rietbroek RC, Van de Vaart PJ, Haveman J, et al. Hyperthermia enhances the cytotoxicity and platinum-DNA adduct formation of lobaplatin and oxaliplatin in cultured SW 1573 cells. J Cancer Res Clin Oncol 1997;123:6-12.
7. Van de Vaart PJ, Van der Vange N, Zoetmulder FA, et al. Intraperitoneal cisplatin with regional hyperthermia in advanced ovarian cancer: pharmacokinetics and cisplatin-DNA adduct formation in patients and ovarian cancer cell lines. Eur J Cancer 1998;34:148-54.
8. Dewhirst MW, Vujaskovic Z, Jones EL, et al. Re-setting the biological rationale for thermal therapy. Int J Hyperthermia 2005;21:779-90.
9. Krawczyk PM, Eppink B, Essers J, et al. Mild hyperthermia inhibits homologous recombination, induces BRCA2 degradation, and sensitizes cancer cells to poly (ADP-ribose) polymerase-1 inhibition. Proc Natl Acad Sci USA 2011;108:9851-6.
10. Eppink B, Krawczyk PM, Stap J, et al. Hyperthermia-induced DNA repair deficiency suggests novel therapeutic anti-cancer strategies. Int J Hyperthermia 2012;28:509-17.
11. Overgaard J. Simultaneous and sequential hyperthermia and radiation treatment of an experimental tumor and its surrounding normal tissue in vivo. Int J Radiat Oncol Biol Phys 1980;6:1507-17.
12. Frey B, Weiss EM, Rubner Y, et al. Old and new facts about hyperthermia-induced modulations of the immune system. Int J Hyperthermia 2012;28:528-42.
13. Repasky EA, Evans SS, Dewhirst MW. Temperature matters! And why it should matter to tumor immunologists. Cancer Immunol Res 2013;1:210-6.
14. Dobšíček Trefná H, Crezee H, Schmidt M, et al. Quality assurance guidelines for superficial hyperthermia clinical trials: I. Clinical requirements. Int J Hyperthermia 2017;33:471-82.
15. Bruggmoser G, Bauchowitz S, Canters R, et al. Quality assurance for clinical studies in regional deep hyperthermia. Strahlenther Onkol 2011;187:605-10.
16. Kok HP, Wust P, Stauffer PR, et al. Current state of the art of regional hyperthermia treatment planning: a review. Radiat Oncol 2015;10:196.
17. Stauffer PR, Van Rhoon GC. Overview of bladder heating technology: matching capabilities with clinical requirements. Int J Hyperthermia 2016;32:407-16.
18. Arends TJ, Nativ O, Maffezzini M, et al. Results of a randomised controlled trial comparing intravesical chemohyperthermia with mitomycin C versus bacillus Calmette-Guérin for adjuvant treatment of patients with intermediateand high-risk non-muscle-invasive bladder cancer. Eur Urol 2016;69:1046-52.
19. Van Driel WJ, Lok CA, Verwaal V, et al. The role of hyperthermic intraperitoneal intraoperative chemotherapy in ovarian cancer. Curr Treat Opt Oncol 2015;16:14.
20. Datta NR, Ordonez SG, Gaipl US, et al. Local hyperthermia combined with radiotherapy and-/or chemotherapy: recent advances and promises for the future. Cancer Treat Rev 2015;41:742-53.
21. Vasanthan A, Mitsumori M, Park JH, et al. Regional hyperthermia combined with radiotherapy for uterine cervical cancers: a multi-institutional prospective randomized trial of the international atomic energy agency. Int J Radiat Oncol Biol Phys 2005;61:145-53.
22. Sneed PK, Stauffer PR, McDermott MW, et al. Survival benefit of hyperthermia in a prospective randomized trial of brachytherapy boost +/- hyperthermia for glioblastoma multiforme. Int J Radiat Oncol Biol Phys 1998;40:287-95.
23. Zhao C, Chen J, Yu B, Chen X. Improvement in quality of life in patients with nasopharyngeal carcinoma treated with non-invasive extracorporeal radiofrequency in combination with chemoradiotherapy. Int J Radiat Biol2014;90:853-8.
24. Shchpotin IB, Evans SR, Chorny V, et al. Intensive preoperative radiotherapy with local hyperthermia for the treatment of gastric carcinoma. Surg Oncol 1994;3:37-44.
25. Desjardins L, Lumbroso-Le Rouic L, Levy-Gabriel C, et al. Combined proton beam radiotherapy and transpupillary thermotherapy for large uveal melanomas: a randomized study of 151 patients. Ophthalmic Res 2006;38:255-60.
26. Datta NR, Rogers S, Ordonez SG, et al. Hyperthermia and radiotherapy in the management of head and neck cancers: a systematic review and meta-analysis. Int J Hyperthermia 2016;32:31-40.
27. Datta NR, Puric E, Klingbiel D, Gomez S, et al. Hyperthermia and radiation therapy in locoregional recurrent breast cancers: a systematic review and meta-analysis. Int J Radiat Oncol Biol Phys 2016;94:1073-87.
28. Datta NR, Rogers S, Klingbiel D, et al. Hyperthermia and radiotherapy with or without chemotherapy in locally advanced cervical cancer: a systematic review with conventional and network meta-analyses. Int J Hyperthermia 2016;32:809-21.
29. Colombo R, Salonia A, Leib Z, et al. Long-term outcomes of a randomized controlled trial comparing thermochemotherapy with mitomycin-C alone as adjuvant treatment for non-muscle-invasive bladder cancer (NMIBC). BJU Int 2011;107:912-8.
30. Sugimachi K, Kuwano H, Ide H, et al. Chemotherapy combined with or without hyperthermia for patients with oesophageal carcinoma: a prospective randomized trial. Int J Hyperthermia 1994;10:485-93.
31. Shen H, Li XD, Wu CP, et al. The regimen of gemcitabine and cisplatin combined with radio frequency hyperthermia for advanced non-small cell lung cancer: a phase II study. Int J Hyperthermia 2011;27:27-32.
32. Issels RD, Lindner LH, Verweij J, et al. Neo-adjuvant chemotherapy alone or with regional hyperthermia for localised high-risk soft-tissue sarcoma: a randomised phase 3 multicentre study. Lancet Oncol 2010;11:561-70.
33. Issels RD, Lindner LH, Verweij J, et al. Effect of neoadjuvant chemotherapy plus regional hyperthermia on long-term outcomes among patients with localized high-risk soft tissue sarcoma: the EORTC 62961-ESHO 95 randomized clinical trial. JAMA Oncol 2018;4:483-92.
34. Van Driel WJ, Koole SN, Sikorska K, et al. Hyperthermic intraperitoneal chemotherapy in ovarian cancer. N Engl J Med 2018;378:230-40.
35. De Jong MA, Oldenborg S, Bing Oei S, et al. Reirradiation and hyperthermia for radiation-associated sarcoma. Cancer 2012;118:180-7.
36. Depla AL, Scharloo-Karels CH, De Jong MA, et al. Treatment and prognostic factors of radiation-associated angiosarcoma (RAAS) after primary breast cancer: a systematic review. Eur J Cancer 2014;50:1779-88.
37. Van der Horst A, Versteijne E, Besselink MG, et al. The clinical benefit of hyperthermia in pancreatic cancer: a systematic review. Int J Hyperthermia 2018;34:969-79.
38. Issels RD. Hyperthermia European Adjuvant Trial (HEAT). ClinicalTrials.gov Identifier: NCT01077427, 2012. Te raadplegen via https://clinicaltrials.gov/ct2/show/NCT01077427, bekeken op 7 juni 2017.
39. Datta NR, Pestalozzi B, Clavien PA, et al. ‘HEATPAC’ – a phase II randomized study of concurrent thermochemoradiotherapy versus chemoradiotherapy alone in locally advanced pancreatic cancer. Radiat Oncol 2017;12:183.
Deel dit bericht op:
Ook interessant voor u